2017年8月16日��,来自德国马克斯普朗克熏染生物学研究所的Thomas F. Meyer博士和美国斯坦福大学医学院的研究人员合作首次发现了幽门螺杆菌导致胃癌的可能机制����。他们发现��,幽门螺杆菌熏染可能通过诱导胃粘膜下方干细胞的过度增殖��,致使干细胞在增殖过程中积累大量的DNA损伤��,从而诱导癌症的发生����。这一发现发表在《自然》杂志上(1)����。

Meyer博士
1875年��,德国一些学者首次在人体的胃中发现了一种螺旋细菌��,但因无法在容器中培植��,研究结果并没有受到太大的重视(2)����。直到一个世纪之后��,1982年��,两名来自澳大利亚的科学家��,鲁宾·华伦和巴利·马歇尔再次疏散出该种细菌��,并发现这一细菌是导致胃溃疡的“元凶”��,才让人们对幽门螺旋杆菌发生了狂热兴趣����。这一发现于1983年发表在《柳叶刀》杂志上(3)����。二人也因此获得了2005年的诺贝尔生理学和医学奖����。

2005年诺贝尔奖颁奖晚会上鲁宾·华伦和巴利·马歇尔博士
而随后的大量研究发现��,幽门螺杆菌不仅可以通过熏染胃粘膜细胞��,引起胃溃疡��,也和胃癌发生密切相关����。例如��,1991年《新英格兰医学》杂志上发表的一项研究表明��,60%的胃腺癌可以归因于幽门螺旋杆菌熏染(4)����。因此��,在1994年��,幽门螺杆菌也被世界卫生组织列为一级致癌物(对人体有明确致癌性的物质或混合物��,如黄曲霉素��,砒霜等等)(5)����。
在我国��,幽门螺杆菌的总体流行率还是很高的����。凭据2002年-2004年对我国19个省市自治区一般人群26341人进行的一项流行病学视察发现��,我国的幽门螺杆菌的总熏染率凌驾56%��,其中广东地域最低为42%��,西藏最高为84.6%(6)����。也就是说��,在我国平均每两个人中就有一个人熏染了幽门螺杆菌����。
同时��,凭据世界卫生组织2014年的统计资料��,我国胃癌死亡人数占全球胃癌死亡人数的比例高达47%(7)����。也就是说��,全球近一半的胃癌患者死亡发生在我们国家����。
虽然��,人们发现幽门螺杆菌熏染与胃癌的发生密切相关��,但是与致癌病毒差异��,细菌不会将致癌基因转入宿主细胞内����。因此��,在此之前��,人们并不清楚幽门螺杆菌是如何诱导胃癌发生的����。
之前��,马克斯普朗克的临床学家Michael Sigal就已经发现��,幽门螺杆菌不仅仅只会熏染胃粘膜外貌的细胞��,而且还会侵入到胃粘膜深部��,到达干细胞池����。同时��,Sigal还视察到��,这些干细胞还会通过增加其破裂来对熏染做出反映(8)����。是不是这个过程导致了胃癌����?那具体机制又是什么呢����?
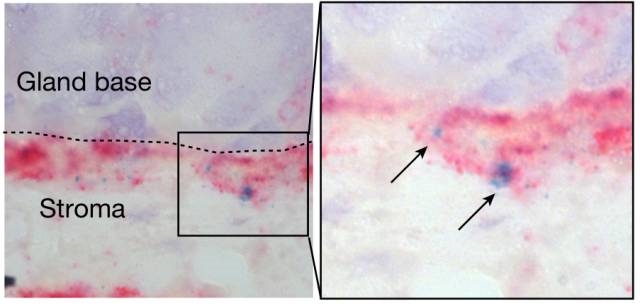
干细胞位于胃腺的底部��,受基质成纤维细胞释放的R-脊髓卵白卵白(箭头)调治增殖活性
已有研究表明��,在正常干细胞增殖过程中��,DNA复制过程中发生的随机突变是一种强烈的致癌因素��,凌驾遗传以及环境因素等(9)����。因此��,幽门螺杆菌很有可能是通过促进胃粘膜干细胞的过度增殖��,引起大量DNA损伤��,最终诱导胃癌的发生����。
为了确定幽门螺杆菌具体是如何促进胃粘膜干细胞增殖的����。Meyer博士接纳单分子原位杂交技术对小鼠胃粘膜干细胞进行系统分析����。结果发现��,小鼠的胃粘膜下��,位于胃腺基底的干细胞池中存在两种差异类型的干细胞����。一种干细胞分化水平低��,增殖能力强��,另一种分化水平较高��,增殖能力较弱����。
同时��,Meyer博士还发现��,当幽门螺杆菌侵入时��,胃粘膜下方的间质成纤维细胞会排泄一种名为R-脊髓卵白(Rspo)的物质��,作用于胃粘膜下方干细胞池��,激活干细胞的WNT通路调治干细胞的增殖以应对幽门螺杆菌熏染����。
但是��,Meyer博士发现��,这两种细胞对WNT通路的反映是差异的����。正常Rspo作用于分化水平低��,增殖较快的干细胞在后��,会使干细胞的增殖速度显著加快��,导致其过度增殖����。而Rspo作用于增殖较慢的细胞后��,会显著抑制其增殖����。
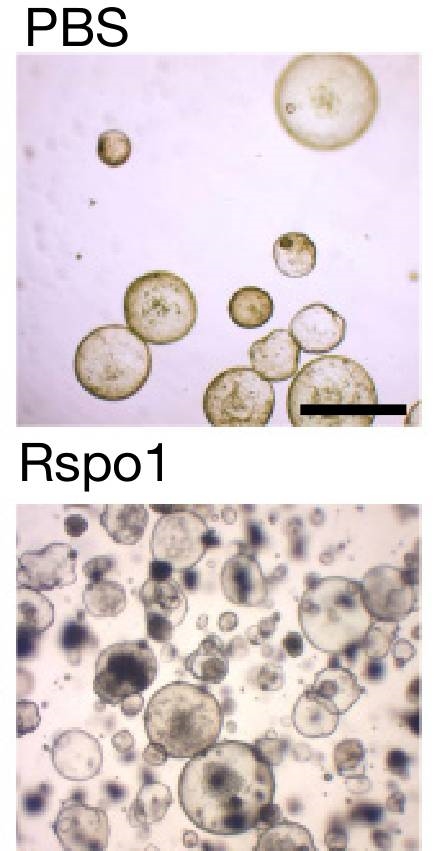
Rspo会显著增强敏感干细胞的扩增速度(单细胞培养24小时)
正如Sigal博士所说��,“由于幽门螺杆菌引起熏染机体无法自我治愈��,因此��,若不治疗��,幽门螺杆菌可能恒久连续刺激间质成纤维细胞排泄Rspo来刺激干细胞破裂��,这也许足以解释为什么幽门螺杆菌熏染会显著增加胃癌风险(10)����。”
总的来说��,Meyer博士的研究揭示了慢性细菌熏染是如何滋扰组织的功效的��,并提供了关于幽门螺杆菌如何增加胃癌风险的首个名贵线索����。而我国人口基数大��,幽门螺杆菌的熏染率高��,这也是我国胃癌发病人数以及死亡人数如此之高的可能原因����。而此前的研究表明��,进行幽门螺杆菌根治治疗可以减少65%的胃癌风险(11)����。因此��,为了减少胃癌的发生��,熏染者还是应该尽早接受幽门螺杆菌根除治疗����。
参考资料:
1.http://www.nature.com/nature/journal/vaop/ncurrent/full/nature23642.html?foxtrotcallback=true
2.https://www.nature.com/scientificamerican/journal/v292/n2/full/scientificamerican0205-38.html
3.Warren JR, Marshall BJ. Unidentifi ed curved bacilli on gastric epithelium in active chronic gastritis. Lancet 1983;I:1273–5.
4.Parsonnet J, Friedman G D, Vandersteen D P, et al. Helicobacter pylori infection and the risk of gastric carcinoma[J]. New England Journal of Medicine, 1991, 325(16): 1127-1131.
5.IARC. Working Group on the Evaluation of Carcinogenic Risks to Humans. Helicobacter pylori. In: Schistosomes, liver fl ukes and Helicobacter pylori views and expert opinions of an IARC Working Group On The Evaluation of Carcinogenic Risks To Humans. Lyon: IARC 1994. p. 177–240.
6.张万岱, 胡伏莲, 萧树东, 等. 中国自然人群幽门螺杆菌熏染的流行病学视察[J]. 现代消化及介入诊疗, 2010, 15(5): 265-270.
7.Stewart B, Wild C P. World cancer report 2014[J]. Health, 2017.
8.Sigal, M. et al. Helicobacter pylori activates and expands Lgr5+ stem cells through direct colonization of the gastric glands. Gastroenterology 148, 1392–404.e21 (2015).
9.Tomasetti C, Vogelstein B. Variation in cancer risk among tissues can be explained by the number of stem cell divisions[J]. Science, 2015, 347(6217): 78-81.
10.https://www.mpg.de/11437780/stomach-cancer-helicobacter-pylori-infection
11.Fuccio L, Zagari R M, Eusebi L H, et al. Meta-analysis: can Helicobacter pylori eradication treatment reduce the risk for gastric cancer?[J]. Annals of internal medicine, 2009, 151(2): 121-128.